Абсолютная температура
Содержание:
- Распределение энергии по степеням свободы
- Градус Фаренгейта, градус Реомюра, градус Ранкина — единицы измерения температуры
- Шкала Кельвина
- Измерение
- Абсолютный нуль температуры
- Измерения по Фаренгейту
- Определение — абсолютная температура
- Газовая температура
- Температура — кельвин
- Примеры задач с решением
- Единицы и шкала измерения температуры
- Взаимодействие атомов между собой
- Кельвин, градус Цельсия — единицы измерения температуры в системе СИ
- Термины
Распределение энергии по степеням свободы
Выражение
для средней энергии молекулы газа учитывает только её среднюю энергию
учитывает только её среднюю энергию
поступательного движения. Но наряду с
поступательным движением, молекула
может вращаться и совершать колебания.
Эти виды движения так же связаны с
некоторым запасом энергии, определить
который, можно пользуясь понятием
статистической физики о равном
распределении энергии по степеням
свободы.
Число
независимых координат, необходимых для
полного описания положения системы в
пространстве, называется
числом степеней свободы
(i).
Так,
например, движение точки, совершающей
перемещение по всей области пространства
в любой момент времени будет полностью
описано тремя координатами, т. е. она
обладает тремя степенями свободы (i=3).
Если на характер
изучаемого движения накладывать
некоторые ограничения, то число степеней
свободы уменьшается.
Так
для описания движения точки по поверхности
необходимо задать две независимые
координаты, т.е. движущаяся по поверхности
точка имеет две степени свободы (i
= 2).
Точка,
совершающая движение по прямой, имеет
одну степень свободы (i
= 1). В общем
случае точка или система точек наряду
с поступательным движением может
одновременно участвовать во вращательном
и колебательном движениях. Общее число
степеней свободы в этом случае будет
равно
 (12.1)
(12.1)
где
iп
— число степеней свободы поступательного
движения точки;
iвр
— число степеней свободы вращательного
движения точки;
iк
— число степеней свободы колебательного
движения точки ( );
);
iкп
— число степеней свободы колебаний точки
при поступательном движении;
iквр
— число степеней свободы колебаний точки
при вращательном движении.
По аналогии с механическими системами,
каждой молекуле, каждому атому газа
можно приписать определённое число
степеней свободы, рассматривая при этом
их как материальные точки. Так, одноатомная
молекула газа имеет только три степени
свободы поступательного движения (i= 3); двухатомная при упругой связи –
шесть степеней свободы (i= 6), а при жёсткой связи — пять степеней
свободы (i= 5);
трёхатомная молекула при жёсткой связи
между атомами имеет шесть степеней
свободы (i= 6).
Известно,
что средняя кинетическая энергия
поступательного движения молекул равна
Поступательное
движение описывается тремя степенями
свободы, а т.к. все степени свободы
равноправны, то на каждую из них приходится

(12.2)
Но
ни один из видов движения (поступательное,
вращательное, колебательное) не имеет
преимуществ перед другими. Следовательно,
можно утверждать: «На любую степень
свободы приходится в среднем одинаковая
энергия, а молекула, обладающая i степенями
свободы, будет обладать энергией ».
».
Данное утверждение называюттеоремой
о равномерном распределении энергии
по степеням свободы
(теорема Больцмана).
Градус Фаренгейта, градус Реомюра, градус Ранкина — единицы измерения температуры
Шкала Фаренгейта и соответственно, такая единица измерения температуры как градус Фаренгейта (${\rm{}^\circ\!F}$) много применялись в англоязычных странах. Сейчас ${\rm{}^\circ\!F}$ используют в быту сравнительно не много стран, например такие как: США, Багамы, Белиз, Палау, Каймановы острова. В Канаде используют и градусы Цельсия и градусы Фаренгейта.
Температура по Цельсию ($t$) и температура по Фаренгейту ($t_F$) соотносятся как:
Так, следуя выражениям (2) температура таяния льда по Фаренгейту при нормальном давлении равна: $t_F=32{\rm{}^\circ\!F}.$
Шкала Реомюра на сегодняшний момент практически не используется. По этой шкале температура плавления льда принята за 0, а точка кипения воды соответствует 80 градусам. Градус Реомюра (${}^\circ R$) соотносится с градусом Цельсия как:
Градус Ранкина (${}^\circ Ra$) используют при инженерных вычислениях в англоязычных странах. Этот градус используется в шкале Ранкина, которая является абсолютной температурной шкалой. Начало шкалы соответствует температуре абсолютного нуля, точка кристаллизации воды $491,67{}^\circ Ra$, .кипении воды происходит при $671,67{}^\circ Ra$. Кельвин и градус Ранкина соотносятся как:
Шкала Кельвина
Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой
Т = t + 273. (3.7.6)
На рисунке 3.11 для сравнения изображены абсолютная шкала и шкала Цельсия.
Единица абсолютной температуры в СИ называется кельвином (сокращенно К). Следовательно, один градус по шкале Цельсия равен одному градусу по шкале Кельвина: 1 °С = 1 К.
Таким образом, абсолютная температура по определению, даваемому формулой (3.7.6), является производной величиной, зависящей от температуры Цельсия и от экспериментально определяемого значения α. Однако она имеет фундаментальное значение.
С точки зрения молекулярно-кинетической теории абсолютная температура связана со средней кинетической энергией хаотического движения атомов или молекул. При Т = 0 К тепловое движение молекул прекращается. Подробнее об этом пойдет речь в главе 4.

Измерение
Температура – это прямое измерение тепловой энергии, то есть чем горячее объект, тем больше тепловой энергии он имеет. Тепло – это мера того, сколько тепловой энергии передается между двумя системами.
Легко повернуть механическую энергию в тепловую, например используя трение. Также можно превратить тепловую энергию в механическую с помощью теплового двигателя, но при этом всегда будет отходящее тепло.
Температура обычно наблюдается в единицах градуса Цельсия или °C (в некоторых странах используется шкала Фаренгейта); однако в научном сообществе наблюдается в единицах Си—Кельвин или K (обратите внимание, что это K не °K). Как Кельвин, так и градусы Цельсия имеют свои преимущества и недостатки
Абсолютный нуль температуры
Предельную температуру, при которой объем идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Однако объем реальных газов при абсолютном нуле температуры обращаться в нуль не может. Имеет ли смысл тогда это предельное значение температуры?
Предельная температура, существование которой вытекает из закона Гей-Люссака, имеет смысл, так как практически можно приблизить свойства реального газа к свойствам идеального. Для этого надо брать все более разреженный газ, так чтобы его плотность стремилась к нулю. У такого газа действительно объем с понижением температуры будет стремиться к предельному, близкому к нулю.
Найдем значение абсолютного нуля по шкале Цельсия. Приравнивая объем V в формуле (3.6.4) нулю и учитывая, что
получим
Отсюда абсолютный нуль температуры равен
t = -273 °С**.
** Более точное значение абсолютного нуля: -273,15 °С.
Измерения по Фаренгейту
Конвертацию значений из Фаренгейта в градусы Цельсия можно осуществить по несложным правилам, учитывая тот факт, что точка замерзания по Цельсию на 32 единицы ниже, чем по Фаренгейту.
Пример:
- 1°F = (1–32) * 0,55555 = — 17 °C;
- 10°F = (10–32) * 0,55555 = — 12 °C;
- 32°F = (32–32) * 0,55555 = 0 °C;
- 50°F = (50–32) * 0,55555 = +10 °C;
- и т. д.

Однако, при обратной конвертации из Цельсия в Фаренгейты, расчёты по приведённой системе будут неточными, поэтому лучше прибегнуть к разработанной Фаренгейтом таблице. А также можно воспользоваться онлайн-калькулятором, размещённым на любом тематическом сайте. Показатели принятой таблицы перевода величин и расчётные данные по онлайн-калькулятору выглядят так:
- 0С = 32 F;
- 1С = 33,8F;
- 10С = 50F;
- 100С = 212F.
Определение — абсолютная температура
Определения абсолютной температуры были выполнены при помощи нагревания в переменном магнитном поле.
Определения абсолютной температуры были выполнены в Лейдене, где использовался нагрев в переменном поле и гистерезисный нагрев, а также в Оксфорде, где применялись у-лучи.
Определения абсолютной температуры были выполнены в Лейдене при помощи нагревания в переменном магнитном поле п в Оксфорде, где использовались у-лучи. Эксперименты с церемонным полем были выполнены при температурах ниже максимума восприимчивости, поскольку выше него — / было слишком мало.
Определения абсолютной температуры были выполнены при помощи нагревания в неременном магнитном иоле.
Определения абсолютной температуры были выполнены Б Лейдене, где использовался нагрев в переменном поле и гисчерезнспын нагрев, а также л Оксфорде, где применялись у-лучп.
Определения абсолютной температуры были выполнены в Лейдене при помощи нагревания в переменном магнитном ноле п н Оксфорде, где использовались у-лучп. Эксперименты с переменным нолем были выполнены при температурах ниже максимума восприимчивости, поскольку выше него /; было слишком мало.
Из определения абсолютной температуры Т следует, что при температуре абсолютного нуля ( Т 0) тепловое движение молекул прекращается.
Для определения абсолютных температур вблизи нуля шкалы Кельвина выражение ( 33) можно записать в другой более удобной форме.
Для определения абсолютной температуры прежде всего необходим вторичный термометр, который должен быть програ-дуирован по абсолютной шкале температур. При более высоких температурах это не вызывает затруднений. Термометр может быть проградуирован отдельно и затем приведен в тепловой контакт с веществом, температура которого измеряется.
При идеализированном определении абсолютной температуры как меры движения газовых молекул абсолютный нуль определяется как такое состояние, в котором исчезает молекулярное движение. В настоящее время это представление признается неверным, независимо от того, конденсируется ли данный газ при низких температурах, переходя в твердое или жидкое состояние, или нет; однако в этой части курса такое упрощенное представление следует изложить как констатацию факта, не объясняя его подробнее, чем это сделано в Учебнике. Абсолютный нуль-это, по определению, такая температура, при которой любая система находится на самом низком энергетическом уровне, какой только возможен, но это состояние системы вовсе не соответствует полному отсутствию движения.
Из самого определения абсолютной температуры Т следует, что она всегда положительна. При температуре абсолютного нуля ( 7 0) тепловое движение молекул прекращается.
Из самого определения абсолютной температуры следует, что она отрицательной быть не может. За начало отсчета абсолютной температуры принят абсолютный нуль, теоретически определяемый.
Анализ возможностей определения абсолютных температур ниже 1 К был опубликован Джиоком в 1953 г. Автор отметил технические трудности, возникающие в описанном методе, при котором требуется сообщение тепла системе при температурах ниже 1 К, и описал метод, не требующий добавления тепла при этих температурах.
Магнитные методы определения абсолютной температуры в случае этой соли сопряжены с трудностями.
Зависимость ек от Т дает определение абсолютной температуры. Термодинамическая температура является физической величиной, пропорциональной средней кинетической энергии поступательного движения молекул идеального газа.
Газовая температура
Для определения газовой температуры нужно вспомнить важное свойство, которое сообщает о том, что в условиях равновесия средняя кинетическая энергия молекул в смеси газов одинаковая для различных компонентов данной смеси. Из данного свойства следует то, что если 2 газа в различных сосудах находятся в тепловом равновесии, тогда средние кинетические энергии молекул данных газов одинаковые
Это свойство мы и будем использовать. К тому же в ходе экспериментов доказано, что для любых газов (при неограниченном числе), которые находятся в состоянии теплового равновесия, справедливо следующее выражение:
С учетом вышесказанного, используем (1) и (2) и получаем:
Из уравнения (3) следует, что величина θ, которой мы обозначили температуру, вычисляется в Дж, в чем измеряется также и кинетическая энергия. В лабораторных работах температура в системе измерения вычисляется в кельвинах. Поэтому введем коэффициент, который уберет данное противоречие. Он обозначается k, измеряется в ДжК и равняется 1,38·10-23. Данный коэффициент называется постоянной Больцмана. Таким образом:
Определение 1
θ=kT (4), где T – это термодинамическая температура в кельвинах.
Связь термодинамической температуры и средней кинетической энергией теплового движения молекул газа выражается формулой:
E=32kT (5).
Из уравнения (5) видно, что средняя кинетическая энергия теплового движения молекул прямо пропорциональна температуре газа. Температура является абсолютной величиной. Физический смысл температуры заключается в том, что она, с одной стороны, определяется средней кинетической энергией, которая приходится на 1 молекулу. А с другой стороны, температура – это характеристика системы в целом. Таким образом, уравнение (5) показывает связь параметров макромира с параметрами микромира.
Определение 2
Известно, что температура – это мера средней кинетической энергии молекул.
Можно установить температуру системы, а затем рассчитать энергию молекул.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать задание
Температура — кельвин
Температура Цельсия ( символ t) определяется выражением: t Т — Т0, Т — температура Кельвина, Т0 273 15 К.
Допускается применять также градус Цельсия С, по размеру равный Кельвину, для выражения температуры Цельсия tT — Te, где Т — температура Кельвина, 7о273 15 К. Тройная точка воды — состояние, при котором находятся в равновесии все г три ее фазы: лед, жидкая вода и насыщенный пар. Равновесие трех фаз воды достигается лишь при вполне определенной тем — пературе 273 16 К0 01 С, в отличие от равновесия каких-либо двух ее фаз, которое возможно и при разных температурах.
Кроме температуры Кельвина, К ( обозначение 7) допускается применение температуры Цельсия, С ( обозначение t), определяемой выражением t — Т-27315 К. Температура Кельвина выражается в кель-винах ( градусах Кельвина), температура Цельсия — в градусах Цельсия. Числовое значение температуры должно сопровождаться значками К и С. По величине кельвин и градус Цельсия равны между собой. Различие состоит лишь в начале отсчета ( см. гл.
Переход от значений температуры в шкале Цельсия к значениям в шкале Кельвина рассматривается в гл. В системе СИ при использовании шкалы температур Кельвина знак градуса не указывается.
Температура таяния льда при нормальном давлении обозначена 0 С. Как видим, разница между абсолютной шкалой температур Кельвина и шкалой Цельсия только в начале отсчета ( в положении нуля) температуры.
Температура Цельсия определяется выражением tT — Тй, где Т — температура Кельвина, Г 273 15 К.
Параметры тройной точки воды следующие: давление насыщенного пара — 4 58 мм рт. ст. 0 006 атм, температура О 01 С. Тройная точка воды является реперной точкой при построении абсолютной термодинамической шкалы температур Кельвина.
Практически для термометрии нет необходимости осуществлять цикл Карно, в котором экспериментальные ошибки обычно очень велики. Температура, введенная во втором законе термодинамики как интегрирующий делитель, как раз и есть температура Кельвина.
В практической термометрии нет необходимости осуществлять циклы Карно, экспериментальные ошибки при проведении которых часто были бы недопустимо велики. Во втором законе термодинамики температура вводится как величина, обратная интегрирующему множителю; можно показать, что температура, определенная таким образом, совпадает с температурой Кельвина.
В практической термометрии нет необходимости осуществлять циклы Карно, экспериментальные ошибки при проведении которых часто были бы недопустимо велики. Во втором законе термодинамики температура водится как величина, обратная интегрирующему множителю; можно показать, что температура, определенная таким образом, совпадает с температурой Кельвина.
Уравнение ( 12) было получено из термодинамического тождества ( 5) и на основе двух изотермических законов поведения идеального газа, а также эмпирического определения величины моля. Величина Т, входящая в уравнение ( 12), та же что и в термодинамическом тождестве ( 5), и, следовательно, является температурой Кельвина.
Однако всякий газ, который строго подчиняется закону Бойля — Мариотта и у которого изменение объема при постоянной температуре не меняет внутренней энергии и, подчиняется закону pv kT, где Т представляет температуру Кельвина. Такой газ, называемый идеальным газом, будучи использован в газовом термометре постоянного давления или постоянного объема, непосредственно воспроизводит шкалу Кельвина.
Кроме температуры Кельвина ( обозначение Т) допускается применять также температуру Цельсия ( обозначение t), определяемую выражением t T — Т, где Г 273 15К по определению. По размеру градус Цельсия равен кельвину. Разность температур Кельвина выражается в Кельвинах. Разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
Кроме температуры Кельвина ( обозначение Т) допускается применять также температуру Цельсия ( обозначение t), определяемую выражением t T — Tn, где Т0 273 15К по определению. По размеру градус Цельсия равен кельвину. Разность температур Кельвина выражается в Кельвинах. Разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
По размеру градус Цельсия равен кельвину. Интервал или разность температур Кельвина выражают в Кельвинах. Интервал или разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
Примеры задач с решением
Пример 1
Задание. Чему станет равна постоянная Больцмана, если за единицу температуры по шкале Кельвина принимать не 1К, а 5 К?
Решение. По условию задачи единица температуры в системе СИ стала больше в пять раз, это означает, что если обозначить температуру по общепринятой шкале как $T$, но по нашей новой шкале ($T_N$) она станет равна:
\
По закону о равномерном распределении энергии по степеням свободы ($i$ — число степеней свободы молекулы) мы имеем:
\
$k=1,38•{10}^{-23}\frac{Дж}{К}$- постоянная Больцмана.
Средняя кинетическая энергия молекул измеряется в Дж и не зависит от масштаба единиц температуры, это означает, что:
\
Вычислим нашу новую «постоянную Больцмана»:
\
Ответ. $k_N=6,9\cdot {10}^{-23}\frac{Дж}{К}$
Пример 2
Задание. Идеальный газ, показателем адиабаты $\gamma =1,4$ сжали, как показано на рис.1. Первоначальная температура газа составляла $T_1=290\ K$. Какой стала температура газа после сжатия? Выразите температуру газа в градусах Цельсия.
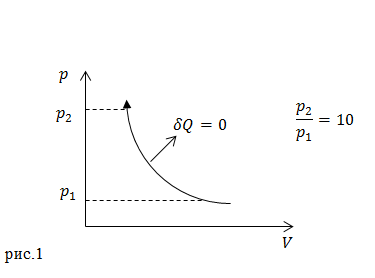
Решение. На рис.1 изображен адиабатный процесс, так как указано, что он происходит без теплообмена ($\delta Q=0$). Для решения нашей задачи удобнее использовать уравнение адиабатного процесса в параметрах $p,T$:
\
Из уравнения (2.1) выразим конечную температуру:
\
Вычислим температуру:
\
Выразим температуру в градусах Цельсия:
\
Ответ. $t=287{\rm{}^\circ\!C}$
Единицы и шкала измерения температуры
Шкала температур Кельвина
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), 1 °F = 9/5 °С + 32. Предложена Г. Фаренгейтом в 1724.
Взаимодействие атомов между собой
При
рассмотрении реальных
газов —
газов,
свойства которых зависят от взаимодействия
молекул, надо учитывать силы
межмолекулярного взаимодействия. Они
проявляются
на расстояниях 10-9
м и быстро убывают при увеличении
расстояния между молекулами. Такие
силы называются короткодействующими.
В XX
в., по мере развития представлений о
строении атома и квантовой механики,
было выяснено, что между молекулами
вещества одновременно действуют силы
притяжения и силы отталкивания. На
рис. 88, априведена
качественная зависимость сил
межмолекулярного взаимодействия от
расстояния r
между молекулами, где Fo
и Fп—
соответственно силы отталкивания и
притяжения, aF—
их результирующая. Силы отталкивания
считаются положительными,а
силы взаимного притяжения —отрицательными.
На
расстоянии r
= rрезультирующая
сила F=0,
т. е. силы притяжения и отталкивания
уравновешивают друг друга. Таким
образом, расстояние rсоответствует
равновесному расстоянию между молекулами,
на котором бы они находились в отсутствие
теплового движения. При r
преобладают
силы отталкивания (F>0),
при r>r
— силы притяжения (F10-9
м межмолекулярные силы взаимодействия
практически отсутствуют (F0).
Элементарная
работа A
силы Fпри
увеличении расстояния между молекулами
на drсовершается
за счет уменьшения взаимной
потенциальной энергии молекул, т. е.
A=Fdr=-dП.
(60.1)
Из
анализа качественной зависимости
потенциальной энергии взаимодействия
молекул от расстояния между ними
(рис. 88, б)следует,
что если молекулы находятся друг от
друга на расстоянии, на котором
межмолекулярные силы взаимодействия
не действуют (г),
то П=0. При постепенном сближении молекул
между ними появляются силы притяжения
(F0).
Тогда, согласно (60.1), потенциальная
энергия взаимодействия уменьшается,
достигая минимума при r=r.
При rrс
уменьшением rсилы
отталкивания (F>0)резко
возрастают и совершаемая против них
работа отрицательна (A=FdrПотенциальная
энергия начинает тоже резко возрастать
и становится положительной. Из данной
потенциальной кривой следует, что
система из двух взаимодействующих
молекул в состоянии устойчивого
равновесия (r=r)
обладает минимальной потенциальной
энергией.
Критерием
различных агрегатных состояний
вещества является соотношение величин
Пmin
и kT.Пmin
— наименьшая потенциальная энергия
взаимодействия молекул — определяет
работу, которую нужно совершить против
сил притяжения для того, чтобы
разъединить молекулы, находящиеся
в равновесии (r=r);kTопределяет
удвоенную среднюю энергию, приходящуюся
на одну степень свободы хаотического
теплового движения молекул.
Если
Пmin0,т.
е. вероятность образования агрегатов
из молекул достаточно мала. Если
IImin>>kT,
то вещество находится в твердом состоянии,
так как молекулы, притягиваясь друг к
другу, не могут удалиться на значительные
расстояния и колеблются около
положений равновесия, определяемого
r0.
Если ПminkT,то
вещество находится в жидком состоянии,
так как в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но не расходясь
на расстояние, превышающее r.Таким
образом, любое вещество в зависимости
от температуры может находиться в
газообразном, жидком или твердом
агрегатном состоянии, причем температура
перехода из одного агрегатного состояния
в другое зависит от значения Пmin
для данного вещества. Например, у инертных
газов Пmin
мало, а у металлов — велико, поэтому
при обычных (комнатных) температурах
они находятся соответственно в
газообразном и твердом состояниях.
Кельвин, градус Цельсия — единицы измерения температуры в системе СИ
В Международной системе единиц (СИ), единицей термодинамической температуры ($T$) является кельвин (К). Это основная единица данной системы единиц. Один кельвин — это термодинамическая температура равная $\frac{1}{273,16}$ части от температуры тройной точки воды. К недостатками такого определения относят то, что попытки получить температуру в один кельвин связаны с зависимостью от чистоты и изотопного состава воды. Существуют попытки дать определение одного кельвина через величину постоянной Больцмана ($k=1,38\cdot {10}^{-23}\frac{Дж}{К}$). Вероятно в таком случае один кельвин — это будет такое изменение температуры, которое ведет к изменению энергии (на одну степень свободы) равному $kT$=$1,38\cdot {10}^{-23}Дж$.
Единица термодинамической температуры именована в честь английского ученого У. Томсона (лорда Кельвина). Вплоть до 1968 г. единицу термодинамической температуры называли градусом Кельвина. Начало шкалы термодинамической температуры совпадает с абсолютным нулем ($T=0К$).
Кратные и дольные единицы кельвина получают используя стандартные приставки системы СИ, например, кК — килокельвин ($1кК={10}^3К$); пК -пикокельвин ($1пК={10}^{-12}К$) и т.д.
Градус Цельсия (${\rm{}^\circ\!C}$) — это еще одна единица измерения температуры ($t$), которую используют в системе СИ совместно с кельвином. Свое название ${\rm{}^\circ\!C}$ получил в честь шведского ученого А. Цельсия, который создал свою шкалу измерения температуры. На сегодняшний момент градус Цельсия равен кельвину, однако ноль шкалы температур по Цельсию сдвинут относительно шкалы Кельвина:
Термины
- Стандарт VSMOW – стандартизированный изотопный состав воды.
- Международная система единиц – стандартный список основных единиц измерения, применимых в научной среде по всему миру.
- Абсолютный ноль – минимальный температурный показатель: ноль по шкале Кельвина, -273.15°C и -459.67°F.
Абсолютной мерой температуры выступает термодинамическая. Это абсолютная шкала, потому что выступает мерой фундаментальной характеристики, находящейся в основе температуры: нулевая точка. Именно при таком показателе все элементы приобретают минимальную активность и сберегают лишь квантовомеханические движения.

Перед вами график зависимости температурного показателя от различных газов при стабильном объеме. Заметьте, что все они экстраполируются к нулевому давлению при одной температуре
К температуре приводит кинетическая энергия в случайных перемещениях от молекул и атомов. Поэтому очень выгодно ориентироваться на абсолютный ноль, воспринимая его как контрольную точку в системе температуры. Чаще всего используют шкалу Кельвина, благодаря которой удается показать, что между средней поступательной кинетической энергией и температурой есть связь:

Реальные газы не всегда способны соответствовать идеальной модели. Здесь видны размеры атомов гелия относительно интервала в масштабе 1950 атмосфер
Заметьте, что нам бы не удалось добиться такой простой формулы, если бы рассматривалась шкала Фаренгейта.