Школьная энциклопедия
Содержание:
- Изопроцессы
- Уравнение состояния идеального газа
- Проблемы энергетики и охрана окружающей среды
- Параметр — состояние — система
- Энтропия
- 1Вопрос Основные термодинамические параметры состояния газа.
- Принципы действия тепловых машин
- Количество теплоты. Удельная теплоемкость вещества
- Теплоемкость газов
- Давление
- Теплопередача
Изопроцессы
С помощью уравнения объединённого газового закона можно исследовать процессы, в которых масса газа и один из важнейших параметров — давление, температура или объём — остаются постоянными. В физике такие процессы называются изопроцессами.
Из объединённого газового закона вытекают другие важнейшие газовые законы: закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, или второй закон Гей-Люссака.
Изотермический процесс
Процесс, в котором изменяются давление или объём, но температура остаётся постоянной, называется изотермическим процессом.
При изотермическом процессе T = const, m = const.
Поведение газа в изотермическом процессе описывает закон Бойля-Мариотта. Этот закон открыли экспериментальным путём английский физик Роберт Бойль в 1662 г. и французский физик Эдм Мариотт в 1679 г. Причём сделали они это независимо друг от друга. Закон Бойля-Мариотта формулируется следующим образом: В идеальном газе при постоянной температуре произведение давления газа на его объём также постоянно.
Уравнение Бойля-Мариотта можно вывести из объединённого газового закона. Подставив в формулу Т = const,получаем
p·V = const
Это и есть закон Бойля-Мариотта. Из формулы видно, что давление газа при постоянной температуре обратно пропорционально его объёму. Чем выше давление, тем меньше объём, и наоборот.
Как объяснить это явление? Почему же при увеличении объёма газа его давление становится меньше?
Так как температура газа не меняется, то не меняется и частота ударов молекул о стенки сосуда. Если увеличивается объём, то концентрация молекул становится меньше. Следовательно, на единицу площади придётся меньшее количество молекул, которые соударяются со стенками в единицу времени. Давление падает. При уменьшении объёма число соударений, наоборот, возрастает. Соответственно растёт и давление.
Графически изотермический процесс отображают на плоскости кривой, которую называют изотермой. Она имеет форму гиперболы.
Каждому значению температуры соответствует своя изотерма. Чем выше температура, тем выше расположена соответсвующая ей изотерма.
Изобарный процесс
Процессы изменения температуры и объёма газа при постоянном давлении, называются изобарными. Для этого процесса m = const, P = const.
Зависимость объёма газа от его температуры при неизменяющемся давлении также была установлена экспериментальным путём французским химиком и физиком Жозефом Луи Гей-Люссаком, опубликовавшем его в 1802 г. Поэтому её называют законом Гей-Люссака «При постоянном давлении отношение объёма постоянной массы газа к его абсолютной температуре является постоянной величиной».
При Р = const уравнение объединённого газового закона превращается в уравнение Гей-Люссака.
Пример изобарного процесса — газ, находящийся внутри цилиндра, в котором перемещается поршень. При повышении температуры растёт частота ударов молекул о стенки. Увеличивается давление, и поршень приподнимается. В итоге увеличивается объём, занимаемый газом в цилиндре.
Графически изобарный процесс отображается прямой линией, которая называется изобарой.
Чем больше давление в газе, тем ниже расположена на графике соответствующая изобара.
Изохорный процесс
Изохорным, или изохорическим, называют процесс изменения давления и температуры идеального газа при постоянном объёме.
Для изохорного процесса m = const, V = const.
Представить такой процесс очень просто. Он происходит в сосуде фиксированного объёма. Например, в цилиндре, поршень в котором не двигается, а жёстко закреплён.
Изохорный процесс описывается законом Шарля: «Для данной массы газа при постоянном объёме его давление пропорционально температуре». Французский изобретатель и учёный Жак Александр Сезар Шарль установил эту зависимость с помощью экспериментов в 1787 г. В 1802 г. её уточнил Гей-Люссак. Поэтому этот закон иногда называют вторым законом Гей-Люссака.
При V = constиз уравнения объединённого газового закона получаем уравнение закона Шарля, или второго закона Гей-Люссака.
При постоянном объёме давление газа увеличивается, если увеличивается его температура.
На графиках изохорный процесс отображается линией, которая называется изохорой.
Чем больше объём занимаемый газом, тем ниже расположена изохора, соответствующая этому объёму.
В реальности ни один параметр газа невозможно поддерживать неизменным. Это возможно сделать лишь в лабораторных условиях.
Конечно, в природе идеального газа не существует. Но в реальных разреженных газах при очень низкой температуре и давлении не выше 200 атмосфер расстояние между молекулами намного превышает их размеры. Поэтому их свойства приближаются к свойствам идеального газа.
- < Назад
- Вперёд >
Уравнение состояния идеального газа
Основное уравнение состояния идеального газа выводится на основе положений молекулярно-кинетической теории. Согласно этой теории, идеальный газ – это вещество в газообразном состоянии, для которого справедливы следующие допущения:
- молекулы представляют собой материальные точки;
- силы взаимного притяжения молекул отсутствуют;
- молекулы движутся хаотично, при этом каждая движется в соответствии с законами механики Ньютона;
- взаимодействия между молекулами состоят только в абсолютно упругих соударениях.

Рис. 1. Идеальный газ.
Согласно основному уравнению молекулярно-кинетической теории, если концентрация молекул газа (количество в единице объема) равно $n$, масса одной молекулы $m_0$, а ее среднеквадратичная скорость $\overline {v^2}$, то давление такого газа равно:
$$p={1\over 3}nm_0\overline {v^2},$$
Поскольку молекулы газа считаются материальными точками, то средняя кинетическая энергия движущейся молекулы равна:
$$\overline E = {m_0\overline {v^2}\over 2}$$
Выразим из этого соотношения массу молекулы, и подставим в предыдущее. Получим:
$$p={2\over 3}n\overline E$$
Средняя энергия молекулы в молекулярно-кинетической теории связана с температурой газа через постоянную Больцмана ($k=1,38×10^{-23}Дж/К$):
$$\overline E = {3\over 2}kT$$
Подставив эту среднюю энергию в предыдущее выражение, получим:
$$p = nkT$$
Наконец, выразим концентрацию молекул как отношение их количества к объему ($n={N\over V}$). В итоге получим:
$$p = {N\over V}kT$$
Или:
$${pV\over T} = Nk = const$$
Данное соотношение было впервые получено и практически доказано в 1834г. Б. Клапейроном, поэтому оно носит название «уравнение Клапейрона».
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
- при сжигании топлива используется кислород из атмосферы, что приводит к снижению содержания кислорода в воздухе;
- при сгорании топлива в атмосферу выделяется углекислый газ. Концентрация углекислого газа в атмосфере повышается. Это изменяет прозрачность атмосферы, так как молекулы углекислого газа поглощают инфракрасное излучение, что ведет к повышению температуры (парниковый эффект);
- при сжигании угля в атмосферу поступают азотные, серные соединения и соединения свинца, вредные для здоровья человека.
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
- выделить систему тел и определить ее тип (замкнутая, адиабатически замкнутая, замкнутая в механическом смысле, незамкнутая);
- выяснить, как изменяются параметры состояния \( (p,V,T) \) и внутренняя энергия каждого тела системы при переходе из одного состояния в другое;
- записать уравнения, связывающие параметры двух состояний системы, формулы для расчета изменения внутренней энергии каждого тела системы при переходе из одного состояния в другое;
- определить изменение механической энергии системы и работу внешних сил по изменению ее объема;
- записать формулу первого закона термодинамики или закона сохранения и превращения энергии;
- решить систему уравнений относительно искомой величины;
- проверить решение.
Основные формулы раздела «Термодинамика»


Параметр — состояние — система
Параметры состояния системы разделяются на внешние и внутренние. Внешними параметрами системы называются физические величины, зависящие от положения в пространстве и различных свойств ( например, электрических зарядов) тел, кото — pine являются внешними но отношению к данной системе. Например, для газа таким параметром является объем V сосуда, в котором находится газ, ибо объем зависит от расположения внешних тел — — стенок сосуда. Для диэлектрика, находящегося в электрическом поле, внешним параметром является напряженность этого поля, связанного с внешними источниками поля. Атмосферное давление является внешним параметром для жидкости в открытом сосуде. Внутренними параметрами системы называются физические величины, зависящие как от положения внешних по отношению к системе тел, так и от координат и скоростей частиц, образующих данную систему.
Параметры состояния системы принято подразделять на внешние и внутренние. Внутренними параметрами системы называют величины, зависящие не только от положения внешних тел, но также от координат и скоростей частиц, образующих рассматриваемую систему.
Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом.
Параметры состояния системы — переменные, определяющие термодинамическое состояние системы и отражающие любое свойство системы.
Параметр состояния системы — это такой ее показатель, изменение которого приводит к изменению состояния системы. Любая последовательность изменения состояния системы составляет термодинамический процесс.
Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, свячанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом. Макроскопическая система находится в термодинамическом равновесии, если ее состояние с течением времени не меняется ( предпола.
Параметры состояния системы разделяются на внешние и внутренние. Внешними параметрами системы называются физические величины, зависящие от положения в пространстве и различных свойств ( например, электрических зарядов) тел, которые являются внешними по отношению к данной системе. Например, для газа таким параметром является объем V сосуда, в котором находится газ, ибо объем зависит от расположения внешних тел стенок сосуда. Для диэлектрика, находящегося в электрическом поле, внешним параметром является напряженность этого поля, связанного с внешними источниками поля. Атмосферное давление является внешним параметром для жидкости в открытом сосуде. Внутренними параметрами системы называются физические величины, зависящие как от положения внешних по отношению к системе тел, так и от координат и скоростей частиц, образующих данную систему. Например, внутренними параметрами газа являются его давление и энергия, которые зависят от координат и скоростей движущихся молекул и от плотности газа.
Параметр состояния системы — это такой ее показатель, изменение которого приводит к изменению состояния системы. Любая последовательность изменения состояния системы составляет термодинамический процесс.
Параметры состояния системы, изменение которых служит признаком наличия взаимодействия данного рода, называются координатами состояния системы. Таким образом v есть механическая координата состояния.
Параметры состояния системы, разности которых играют роль движущей силы процесса, называются потенциалами.
Некоторые параметры состояния системы, например объем, могут иметь не одно значение, если в системе имеется больше одной фазы ( см. фиг. Однако для гомогенной системы оказывается верной простая формулировка, приведенная в тексте.
Как параметр состояния системы, фазовая насыщенность может играть существенную роль в области, где весьма велики капилярные силы.
|
К пояснению свойств термодинамических функций. |
Изменение параметров состояния системы называют термодинамическим процессом. Если в ходе последнего состояние системы в любой момент времени остается равновесным, то его называют обратимым. Если равновесность системы в ходе процесса нарушается, то процесс — необратим. Хотя обратимый термодинамический процесс практически не реализуем, к нему часто обращаются при теоретических исследованиях.
Скорости приближения параметров состояния системы к равновесию, в соответствии с теорией, характеризуют потоки энергии или вещества.
Энтропия
Второе начало термодинамики гласит, что энтропия изолированной системы не уменьшается. Другая формулировка постулирует, что энергия никогда не переходит от тела с более низкой температурой к более нагретому. Это, в свою очередь, отрицает возможность создания вечного двигателя, так как нельзя всю энергию, имеющуюся у тела, перевести в работу.
Само понятие «энтропия» было введено в обиход еще в середине 19 века. Тогда оно воспринималось как изменение количества тепла к температуре системы. Но такое определение подходит только к процессам, которые постоянно находятся в состоянии равновесия. Из этого можно вывести следующее заключение: если температура тел, составляющих систему, стремится к нулю, то и энтропия будет равна нулю.
Энтропия как термодинамический параметр состояния газа используется в качестве указания на меру беспорядочности, хаотичности движения частиц. Ее используют, чтобы определить распределение молекул в определенной области и сосуде, либо чтобы посчитать электромагнитную силу взаимодействия между ионами вещества.
1Вопрос Основные термодинамические параметры состояния газа.
Давление
Р
– мера силы, которая действует на единицу
поверхности:
Р
= lim ∆Fn / ∆S = dFn/ dS,
где
DS → 0; ∆Fn – сила, направленная
перпендикулярно участку поверхности.
Удельный
объем
V
– величина, обратная плотности
rвещества:
v
= 1 / r= dV/ dm,
где
dV– бесконечно малый элемент объема;
dm–
масса вещества.
Моль
Количество
вещества, которое содержит число молекул,
равное числу атомов, содержащихся в 12
г изотопа углерода 12С, называется
молем.
Число
Авогадро
NA=
6,02 ч 1023 моль-1. Величина, необходимая при
расчетах. Показывает, сколько молекул
содержится в одном моле любого
вещества.
Молярная
масса
М
– масса одного моля:
М
= NAm × 1а. е. м,
где
NA– число Авогадро;
m–
молекулярная масса.
Молярная
масса = кг/моль и молярный объем =
м3/моль.
Объем
одного моля – молярный объем:
VM
= M / r
где
M– молярная масса;
r–
плотность вещества.
Формулы
для определения числа молей вещества
и числа молекул вещества имеют следующий
вид:
u=
m /M= V/ VM,
N
= uNA= (m / M)NA = (V/ VM)NA.
Температура
За
меру температуры принято брать среднюю
кинетическую энергию поступательного
движения молекул. Если два тела при
соприкосновении не обмениваются энергией
путем теплообмена, можно говорить, что
эти тела имеют одинаковую температуру
и в системе существует тепловое
равновесие.
2вопрос:
Материальный баланс процесса горения:
Для расчета процессов
горения
твердого и жидкого
топлива составляют материальный баланс
процесса горения.
Материальный
баланс процесса горения выражает
количественные соотношения между
исходными веществами (топливо, воздух)
и конечными продуктами (дымовые газы,
зола, шлак) При сжигании твердого и
жидкого топлива горючие вещества могут
окисляться с образованием оксидов
различной степени окисления.
Стехиометрические уравнения
реакций горения углерода, водорода и
серы можно записать так:
а)
С+О2=СО2;
б)
С+(1/2)·О2=СО;
в)
S+О2=SО2;
г)
H2+(1/2)·О2=H2О;
При расчете объемов воздуха и продуктов
сгорания условно принимают, что все
горючие вещества окисляются полностью
с образованием только оксидов с наивысшей
степенью окисления (реакции а, в, г).
Из уравнения (а)следует, что для полного окисления 1
кмоль углерода (12 кг) расходуется 1 кмоль,
т. е. 22,4 м3, кислорода и образуется 1 кмоль
(22,4 м3) оксида углерода. Соответственно
для 1 кг углерода потребуется 22,4/12 = 1,866
м3 кислорода и образуется 1,866 м3 СО2.
В 1 кг топлива содержится Сp/100 кг углерода.
Для его горения необходимо 1,866·Сp/100
м3 кислорода и при сгорании образуется
1,866 Сp/100 м3 CO2.
Аналогично из уравнений
(в) и (г)на окисление горючей серы
(μs = 32), содержащейся в 1 кг топлива,
потребуется (22,4/32) Spл/100 м3 кислорода
и образуется такой же объем SO2. А на
окисление водорода (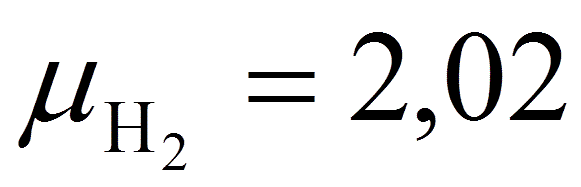 ),
),
содержащегося в 1 кг топлива, потребуется
0,5·(22,4/2,02) Нp/100 м3 кислорода и образуется
(22,4/2,02) Нp/100 м3 водяного пара.
Суммируя полученные выражения и учитывая
кислород, находящийся в топливе(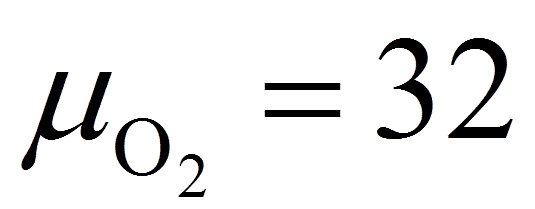 ),после
),после
несложных преобразований получим
формулу для определения количества
кислорода, теоретически необходимого
для полного сжигания 1 кг твердого или
жидкого топлива, м3/кг:
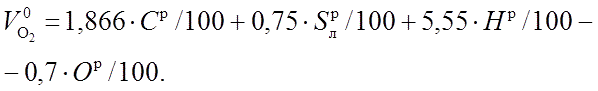
В воздухе содержится кислорода примерно
21 % по объему, поэтому количество воздуха,
теоретически необходимое для полного
сжигания 1 кг топлива V0, м3/кг, составляет:
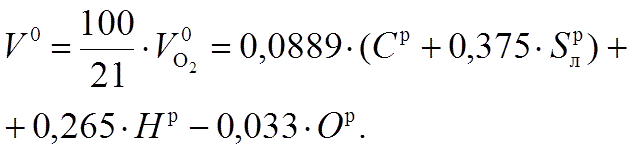
В процессе полного горения с теоретически
необходимым количеством воздуха
образуются газообразные продукты,
которые состоят из CO2, SO2, N2 и H2O — оксиды
углерода и серы являются сухими
трехатомными газами. Их принято объединять
и обозначать через RO2 = CO2 + SO2.
Принципы действия тепловых машин
Тепловым двигателем называют устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Основные части теплового двигателя:
- Нагреватель – тело с постоянной температурой, преобразующее внутреннюю энергию топлива в энергию газа. В каждом цикле работы двигателя нагреватель передает рабочему телу некоторое количество теплоты.
- Рабочее тело – это газ, совершающий работу при расширении.
- Холодильник – тело с постоянной температурой, которому рабочее тело передает часть тепла.
Любая тепловая машина получает от нагревателя некоторое количество теплоты \( Q_1 \) и передает холодильнику количество теплоты \( Q_2 \). Так как \( Q_1 > Q_2 \), то совершается работа \( A’ = Q_1 – Q_2 \).
Тепловой двигатель должен работать циклически, поэтому расширение рабочего тела должно сменяться его сжатием. Работа расширения газа должна быть больше работы сжатия, совершаемой внешними силами (условие совершения полезной работы). Температура газа при расширении должна быть выше, чем температура при сжатии. Тогда давление газа во всех промежуточных состояниях при сжатии будет меньше, чем при расширении.
В реальных тепловых машинах нагревателем является камера сгорания. В них рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Количество теплоты, выделяющееся при сгорании топлива, вычисляется по формуле:
где \( q \) – удельная теплота сгорания топлива, \( m \) – масса топлива.
Холодильником чаще всего у реальных двигателей служит атмосфера.
Виды тепловых двигателей:
- паровой двигатель;
- турбина (паровая, газовая);
- двигатель внутреннего сгорания (карбюраторный, дизельный);
- реактивный двигатель.
Тепловые двигатели широко используются на всех видах транспорта: на автомобилях – двигатели внутреннего сгорания; на железнодорожном транспорте – дизельные двигатели (на тепловозах); на водном транспорте – турбины; в авиации – турбореактивные и реактивные двигатели. На тепловых и атомных электростанциях тепловые двигатели приводят в движение роторы генераторов переменного тока.
Количество теплоты. Удельная теплоемкость вещества
Количество теплоты – это скалярная физическая величина, равная энергии, которую тело получило или отдало при теплопередаче.
Обозначение – \( Q \), в СИ единица измерения – Дж.
Удельная теплоемкость – это скалярная физическая величина, численно равная количеству теплоты, которое тело массой 1 кг получает или отдает при изменении его температуры на 1 К.
Обозначение – \( c \), в СИ единица измерения – Дж/(кг·К).
Удельная теплоемкость определяется не только свойствами вещества, но и тем, в каком процессе осуществляется теплопередача. Поэтому выделяют удельную теплоемкость газа при постоянном давлении – \( c_P \) и удельную теплоемкость газа при постоянном объеме – \( c_V \). Для нагревания газа на 1 К при постоянном давлении требуется большее количество теплоты, чем при постоянном объеме – \( c_P > c_V \).
Формула для вычисления количества теплоты, которое получает тело при нагревании или отдает при охлаждении:
где \( m \) – масса тела, \( c \) – удельная теплоемкость, \( T_2 \) – конечная температура тела, \( T_1 \) – начальная температура тела.
Важно!
При решении задач на расчет количества теплоты при нагревании или охлаждении можно не переводить температуру в кельвины. Так как 1К=1°С, то\( \Delta T=\Delta t \)
Теплоемкость газов
При
проведении тепловых расчетов газопроводов
необходимо знать значение удельных
теплоемкостей газов. Удельной теплоемкостью
газа называется количество тепла,
которое необходимо сообщить единице
массы (или объема) газа, чтобы температура
его в данном процессе изменилась на 1°
С.
Теплоемкость
газа зависит от характера протекаемого
процесса. Например, если в газгольдере
находится газ, который подогревается
на 1°С, но при этом в различных случаях
объем газа меняется по-разному. Работа
газа будет различной. В связи с этим и
теплоемкость газа будет не одинакова.
Она будет зависеть от характера
протекающего процесса.
Наибольшее
распространение в термодинамических
расчетах получили теплоемкости двух
простейших процессов: при постоянном
давлении Сри
при постоянном объеме Сv.
В
каком-либо определенном процессе
изменения состояния газа количество
тепла, необходимое для нагревания 1 кг
газа на 1°С при данном давлении, зависит
от абсолютной температуры газа. Количество
тепла оказывается разным при различных
температурах газа. При данной температуре
газа количество тепла, необходимое для
нагревания 1 кг газа на 1°С, зависит от
величины давления.
Для городских
газопроводов теплоемкость газов
изменяется в узких пределах, поэтому
величину теплоемкости можно принимать
постоянной.
Значения
массовой теплоемкости Срнекоторых
газов (в кДж/(кг∙К):
При
При
0°С
100°С
Бутан……….1,592 2,021
Воздух………1,003 1.010
Метан……….2,165 2.448
Пропан………1,549 2,016
В табл. 7.2 приведены
значения массовой теплоемкости при
постоянном давлении для метана в
зависимости от давления и температуры.
Для идеальных газов справедливо
соотношение (закон Майера):
(7.10)
гдеср—
удельная теплоемкость при постоянном
давлении в Дж/(кг∙К); сυ
— удельная теплоемкость при постоянном
объеме в Дж/(кг∙К); R—
газовая постоянная в Дж/(кг∙К).
Таким
образом, если известна величина удельной
теплоемкости при постоянном давлении,
можно определить теплоемкость при
постоянном объеме.
Массовые удельные
теплоемкости при постоянном давлении
и постоянном объеме идеальных газов
являются функцией только одной
температуры, т. е. зависят только от
температуры.
Таблица 7.2
Массовые
теплоемкости Ср(в
кДж/(кг∙К)
метана при постоянном давлении
-
Температура,
°СДавление, МПа
0,0980
1,010
2,020
3,030
4,040
-30
-20
-10
0,0
+10
+20
+30
2,022
2,064
2,110
2,152
2,192
2,231
2,273
2.106
2,148
2,185
2,223
2,261
2,298
2,336
2,223
2,244
2,269
2,307
2,340
2,378
2,407
2,370
2,360
2,370
2,395
2.424
2,457
2,483
2,554
2,499
2,487
2,491
2,512
2,537
2,554
Давление
Давление–это
силовое воздействие (F)
тела и его частей на окружающую среду
или оболочку и на соседние части того
же тела на единицу поверхности (S).
Это силовое воздействие направлено
перпендикулярно к любому элементу
поверхности и уравновешивается обратно
направленным силовым воздействием
окружающей среды, оболочки или соседнего
элемента того же тела.
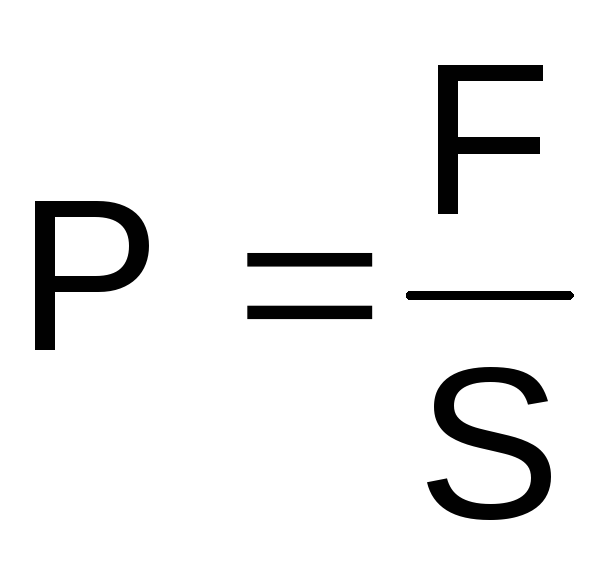 .
.
В
СИ используется единица давления паскаль
(Па), это 1 Н/м2,
т.е. сила в один ньютон, действующая по
нормали на площадь в один квадратный
метр. Для технических измерений паскаль
очень небольшая величина, поэтому ввели
кратную паскалю единицу давления бар:
1 бар = 105
Па. Выбор этой единицы измерения давления
объясняется тем, что атмосферное
давление воздуха над поверхностью Земли
приблизительно равно одному бару.
В
технике часто используется единица
давления в старой системе измерения
(СГС) – техническая
атмосфера:
1 атм = 1 кгс/см2
(не путать с понятием физической
атмосферы).
Часто
измеряют давление, особенно небольшое,
высотой столба жидкости (ртуть, вода,
спирт и т.д.). Столб жидкости (рис.1.5)
производит на основание сосуда давление,
определяемое равенством
Р
= F/S = HSρg/S
= ρgH,
(1.4)
где
ρ – плотность жидкости, кг/м3;
Н
– высота столба жидкости, м;
g
– ускорение свободного падения, м/с2;
F,
S – сила, действующая на дно сосуда, и
его площадь.
Из
уравнения (1.4) следует, что давлению Р
соответствует высота столба жидкости
Н = Р/(ρg), т.е. высота Н прямо пропорциональна
давлению, поскольку ρg – величина
постоянная.
В
практике высоту столба жидкости часто
берут для оценки давления. Поэтому метры
и миллиметры столба жидкости стали
единицами измерения давления. Для
перехода от высоты столба жидкости к
паскалям необходимо в формулу (1.4)
подставить все величины в СИ.
Например,
при 0оC
плотность воды составляет 1000 кг/м3,
ртути – 13595 кг/м3
в земных условиях. Подставив эти величины
в формулу (1.4), получим соотношения для
1мм столба этих жидкостей и давления в
паскалях:
Н
= 1 мм вод.ст. соответствует Р= 103·9,81·10-3=
9,81 Па;
Н
= 1 мм рт.ст. соответствует Р = 13595·9,81·10-3=
133,37 Па.
При
определении давления высотой столба
жидкости необходимо учитывать изменение
ее плотности в зависимости от температуры.
Это необходимо делать для сопоставления
результатов измерения давления. Так,
при определении атмосферного давления
с помощью ртутного барометра его
показания приводятся к 0 оС
исходя из соотношения
Во
= В (1 — 0,000172 t),
(1.5)
где
В – действительная высота ртутного
столба барометра при температуре ртути
t оС;
Во
– показания барометра, приведенные к
температуре 0 оС.
В
расчетах используются давления столбов
жидкости, приведенные к температуре 0
оС.
Измерение
давления
в технике основано на показаниях
различных приборов, действующих по
принципу отражения на шкале величины,
численно равной разности давлений в
месте замера и давления окружающей
среды. Как правило, приборы имеют
положительную шкалу, т.е. разность между
большим и меньшим давлением. Поэтому
они подразделяются на приборы для замерадавления:больше
атмосферного –манометры,
меньше атмосферного –вакуумметры.
П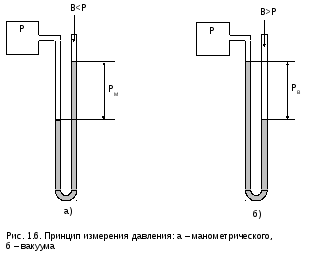 ример
ример
таких приборов в виде жидкостных
U-образных манометров (вакуумметров)
показан на рис. 1.6.
Давление
по шкале этих приборов называется
манометрическим давлением РМ
и вакуумом РВ
соответственно. Давление в месте замера
называется абсолютным Р, окружающей
среды – давлением атмосферного воздуха
или барометрическим В, поскольку прибор,
как правило, установлен в окружающем
его атмосферном воздухе.
Расчетные
зависимости давления по приборам будут
следующие:
манометрическое
давление:
РМ
= Р — В,
(1.6)
где
РМ
– манометрическое давление (по прибору);
Р
– абсолютное давление;
В
– давление атмосферного воздуха
(барометрическое давление);
вакуум:
РВ
= В — Р,
(1.7)
где
РВ
– вакуум (показания вакуумметра).
Параметром
состояния термодинамического тела
является абсолютное давление, при
использовании приборов оно будет
определяться в зависимости от типа
прибора по следующим зависимостям:
для
манометра
Р
= РМ
+ В,
(1.8)
для
вакуумметра
Р
= В — РВ
. (1.9)
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.