Выбираем теплоноситель этилен/пропиленгликоль
Содержание:
- Характеристика общих химических свойств
- Недостатки воды как теплоносителя
- Меры безопасности [ править | править код ]
- Применение гликоля в разных областях техники
- Некоторые нюансы производства гликоля
- Виды и особенности
- В чем разница G12 и G11, G12 и G13
- Характеристики диэтиленгликоля
- Очистка и осушение
- Основы мер безопасности. Зачем избегать замерзание этого спирта?
- Об этиленгликоле
- Физические свойства водного раствора этиленгликоля
- Что такое этиленгликоль
- Применение [ править | править код ]
- Что представляет собой пропиленгликоль
- Как правильно использовать теплоносители на основе пропиленгликоля
- Применение гликолей в промышленности
- Требования к антифризам
- Как получают пропиленгликоль?
Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.

Недостатки воды как теплоносителя
Когда теплоносителем является вода, процесс обогрева помещения отопительной системой менее эффективен. Происходит быстрый износ трущихся частей оборудования, ухудшение теплообмена. Последнее обстоятельство обусловлено тем, что на металлических поверхностях выпадают соли жесткости.
Даже после того, как эти поверхности очищены, промыты и пущены в эксплуатацию повторно, они снова покрываются солью и ржавчиной. Особенно это сказывается, когда водой покрыта не вся металлическая поверхность, а лишь часть ее.

Замерзание воды, ко всему прочему, становится причиной разгерметизации системы. В этом случае лучше применять тосол для систем отопления. Чтобы замерзала вода при более низкой температуре, в нее вводится, к примеру, этиленгликоль.
С коррозией борются присадки-ингибиторы.
Для снижения уровня образования коррозии и отложения солей, улучшения теплофизических свойств, в водные растворы вводят антифриз. Незамерзайка в систему отопления, тем качественнее, чем удачнее выбрано сочетание целевых добавок.

Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
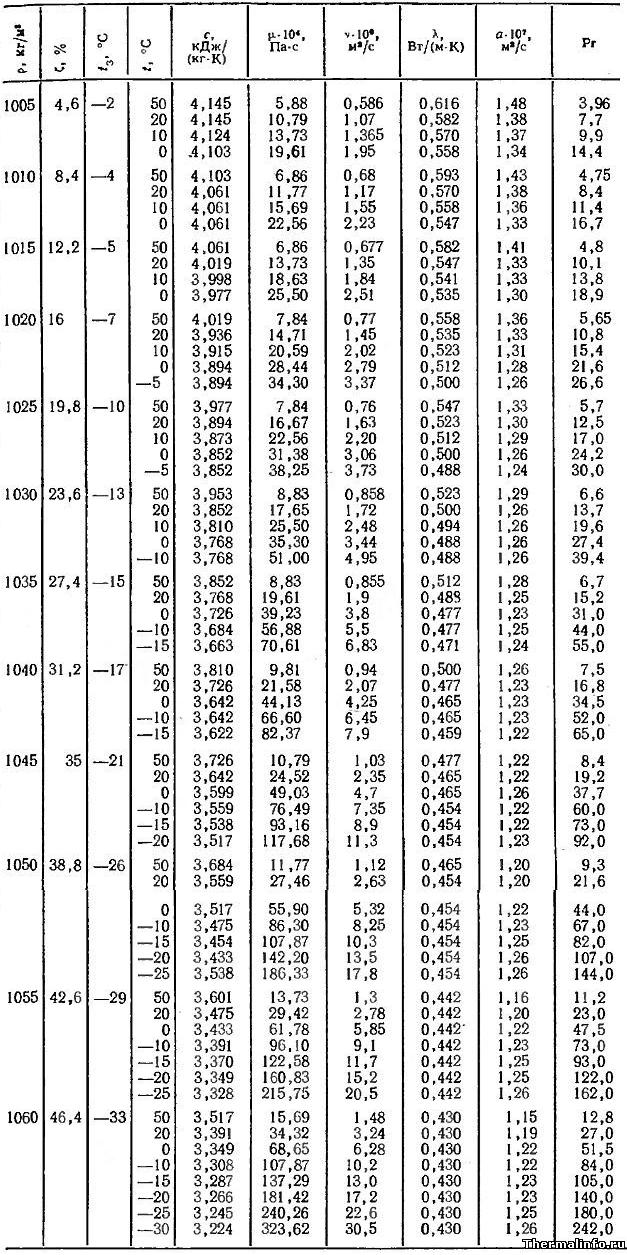
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):
Химические свойства многоатомных спиртов
1. С активными металлами:
2. С гидроксидом меди( II ) – качественная реакция!
1. С галогенводородными кислотами
Т ринитроглицерин — основа динамита
- Этиленгликольпроизводства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканейи в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Применение гликоля в разных областях техники
Малая себестоимость данного многоатомного спирта, его особые химические и физические свойства (плотность и другие) привели к тому, что он используется весьма широко в различных технических сферах.
Любой автомобилист знает, что представляет собой обычная охлаждающая жидкость для его «железного коня» под названием антифриз – этиленгликоля 60 % + воды 40 %. Такая смесь характеризуется температурой замерзания -45 градусов, очень трудно найти более подходящую жидкость для автомобильных систем охлаждения, несмотря даже и на высокий класс опасности 1,2-этандиола.

В автомобильной отрасли этиленгликоль находит применение и в качестве отличного теплоносителя. Кроме того, он используется в следующих сферах:
- органический синтез: химические свойства гликоля позволяют с его помощью защищать изофорон и другие карбонильные группы, использовать спирт в виде эффективного растворителя, работающего при повышенных температурах, а также в качестве основной составляющей специальной авиационной жидкости, уменьшающей явление обводнения горючих смесей для летательных аппаратов;
- растворение красящих соединений;
- изготовление нитрогликоля – мощного взрывчатого вещества на основе описываемого нами соединения;
- газодобывающая промышленность: гликоль не позволяет формироваться гидрату метана на трубах, кроме того, он поглощает излишнюю влагу на трубопроводах.

Некоторые нюансы производства гликоля
В конце 1850-х годов химик из Франции Вюрц получил этиленгликоль из его диацетата, а чуть позже путем гидратации этиленоксида. Но в то время практического применения новое вещество нигде не нашло. Лишь в 1910-х годах его начали использовать при изготовлении взрывчатых соединений. Плотность гликоля, его иные физические свойства и дешевизна производства обусловили то, что им заменили глицерин, который применялся до этого.
Особые свойства 1,2-этандиола по достоинству оценили американцы. Именно они наладили в середине 1920-х его промышленное изготовление на специально построенном и оборудованном заводе в Западной Вирджинии. В последующие годы гликоль использовали почти все известные на то время компании, занимавшиеся производством динамита. В настоящее время интересующее нас соединение, которое имеет третий класс опасности, изготавливается по технологии гидратации окиси этилена. Существует два варианта его производства:
- с участием ортофосфорной либо серной кислоты (до 0,5 процентов) при температуре от 50 до 100 °С и давлении в одну атмосферу;
- при температуре около 200 °С и давлении в десять атмосфер.

В результате реакции гидратации образуется до 90 процентов чистого 1,2-диоксиэтана, некоторое количество полимергомологов и триэтиленгликоля. Второе соединение добавляют в гидравлические и тормозные жидкости, оно применяется в промышленных системах охлаждения воздуха, из него делают препараты для дезинфекции, а также пластификаторы.
Виды и особенности


Для обогрева загородных домов и дач устраивается автономная система отопления. Она состоит из нагревательного котла, соединённого с радиаторами отопления разветвлённой системой трубопроводов. Заливаемая в них незамерзающая жидкость выполняет роль теплоносителя. После нагревания в котле она поступает по трубам к радиаторам.
Незамерзающую жидкость принято называть антифризами. Их химический состав не позволяет им замерзать даже в самые сильные морозы. Антифризы предотвращают появление коррозии на внутренней поверхности труб и радиаторов и не образует на ней накипи. Выбор вида теплоносителя для заливки в отопительную систему от различных факторов, в числе которых климатические условия региона его использования.
Помимо антифриза, выполняющего роль теплоносителя, правила эксплуатации отопительной системы требуют её периодической промывки специальными жидкостями. Их состав содержит различные присадки.
Альтернативным вариантом таким промывочным жидкостям может служить водный раствор каустической соды. Заполняют им систему на 1-1,5 часа. Делают это для растворения содовым раствором скопившейся на внутренних поверхностях элементов отопительной системы накипи.
В продаже можно встретить антифризы с различными характеристиками. В качестве их основы могут использоваться:
Глицерин
Этиленгликоль
Пропиленгликоль
Все эти вещества имеют высокую степень агрессивности, поэтому производители добавляют в их состав различные присадки. Основной компонент антифриза определяет его свойства. Самую доступную стоимость имеют незамерзающие жидкости на основе этиленгликоля, но они и наиболее токсичные.
Незамерзающие жидкости на основе этиленгликоля нельзя применять для двухконтурных котлов. Попадание такого антифриза в систему водоснабжения может вызвать тяжёлое отравление. Жидкость закипает при температуре выше 110°С и может дать осадок. Он часто становится причиной выхода системы отопления из строя.
 Менее опасны и вредны для организма человека антифризы на основе пропиленгликоля. Экологически безопасны незамерзающие жидкости, изготовленные на основе глицерина.
Менее опасны и вредны для организма человека антифризы на основе пропиленгликоля. Экологически безопасны незамерзающие жидкости, изготовленные на основе глицерина.
Антифризы этого вида хорошо защищают систему отопления от коррозии. Особенностью глицериновых незамерзающих жидкостей является то, что при переходе в твёрдое состояние они не увеличиваются в объёме.
Самая низкая температура замерзания и наиболее высокая точка кипения, а также теплопередающая способность у раствора бишофита. Очень часто в системы отопления в качестве теплоносителя используют растворы кальция, натрия и других минеральных солей. Их достоинством считается высокая коррозийная агрессивность.
В чем разница G12 и G11, G12 и G13
Основные виды антифризов, такие как G11, G12 и G13 отличаются по виду используемых присадок: органические и неорганические.

Общие сведения об антифризах, в чем между ними отличие и как подбирать нужную ОЖ
Охлаждающая жидкость класса G11 неорганического происхождения с малым набором присадок, наличием фосфатов и нитратов. Такой антифриз создан по силикатной технологии. Силикатные присадки покрывают внутреннюю поверхность системы сплошным защитным слоем в не зависимости от наличия участков коррозии. Хотя такой слой и защищает уже существующие очаги коррозии от разрушений. Такой антифриз имеет низкую стабильность, ухудшенную теплоотдачу и небольшой строк эксплуатации, после выработки, которого, выпадает в осадок, образовывающий абразив и повреждающий тем самым .
Через то, что антифриз G11 создает слой подобный накипи в чайнике, он не подходит для охлаждения современных авто, имеющих радиаторы с тонкими каналами. К тому же, температура кипения такой охлаждайки составляет 105 °С, а строк службы не более 2-х лет или 50-80 тыс. км. пробега.
Зачастую антифриз G11 окрашивается в зеленый или синий цвета. Такую ОЖ применяют для автомобилей, выпущенных до 1996 года и машины с большим объёмом охлаждающей системы.
G11 плохо подходит к алюминиевым радиаторам и блокам, так как его присадки не могут должным образом защищать этот металл при высоких температурах.
В Европе авторитетная спецификация классов антифризов принадлежит концерну Volkswagen поэтому соответствующая маркировка VW TL 774-C предусматривает использование в антифризе неорганических присадок и имеет обозначение G 11. Спецификация VW TL 774-D предусматривает наличие карбо-кислотных добавок на органической основе и маркируется как G 12. Стандартами VW TL 774-F и VW TL 774-G маркируются классы G12 + и G12 ++, а самый сложный и дорогостоящий антифриз G13 регламентируется стандартом VW TL 774-J. Хотя другие производители такие как Форд или Тойота имеют свои стандарты качества. Кстати разницы между тосолом и антифризом нету. Тосол – одна из марок русского минерального антифриза, которая не рассчитан на работу в моторах с алюминиевым блоком.
Органические и неорганические антифризы смешивать категорически нельзя, поскольку возникнет процесс свертывания и в результате появится осадок в виде хлопьев!
А жидкости классов G12, G12 + и G13 разновидности органических антифризов «Long Life». Применяются в системах охлаждения современных авто выпускаемых начиная с 1996 г. G12 и G12 + на основе этиленгликоля но только G12 plus предполагает использование гибридной технологии производства в которой объединили силикатную технологию с карбоксилатную. В 2008 году появился еще и класс G12++, у такой жидкости, органическая основа сочетается с небольшим количеством минеральных присадок (называется лобридной Lobrid или SOAT coolants). У гибридных антифризах органические присадки смешиваются вместе с неорганическими (могут применяться силикаты, нитриты и фосфаты). Такое объединение технологий дало возможность устранять главный недостаток антифриза G12 – не только устранять коррозию, когда она уже появилась, но и выполнять профилактическое действие.
G12+, в отличии от G12 или G13 может быть смешана с жидкостью класса G11 или G12, но все равно такой «микс» не рекомендован.
Охлаждающая жидкость класса G13 начала производится с 2012-го и рассчитана для автомобильных двигателей работающих в экстремальных режимах. С технологической точки зрения отличий от G12 не имеет, единственная разница в том, что сделана на пропилен гликоле, который менее ядовитый, быстрее разлагается, а значит, наносит меньший вред окружающей среде при его утилизации и его цена значительно выше G12-го антифриза. Изобретался исходя из требований к повышению экологических норм. Антифриз G13, как правило, фиолетового или розового цвета, хотя на самом деле может окрашиваться любым цветом, так как это всего лишь краситель, от которого её характеристики не зависят, разные производители могут выпускать ОЖ с разными цветами и оттенками.

Разница в действии карбоксилатного и силикатного антифризов
Характеристики диэтиленгликоля
- Молекулярная масса 106,12
- Плотность (при 20°С), кг/м 3 1118
- Температура кипения (при атмосферном давлении) °С 245
- Температура замерзания (при атмосферном давлении) °С -8
- Вязкость (при 20°С), Н·сек/м 2 0,0357
- Удельная теплоемкость, Дж/г °С 2,09
- Теплота испарения, кДж/моль 68,87
- Давление насыщенного пара (при 20°С), Па 3 1126
- Температура кипения (при атмосферном давлении) °С 285
- Температура замерзания (при атмосферном давлении) °С -7,6
- Вязкость (при 20°С), Н·сек/м 2 0,0478
- Удельная теплоемкость, Дж/г °С 2,2
- Теплота испарения, кДж/моль 62,6
- Давление насыщенного пара (при 20°С), Па 3 1034
- Температура кипения (при атмосферном давлении) °С 188
- Температура замерзания (при атмосферном давлении) °С -60
- Вязкость (при 20°С), Н·сек/м 2 0,056
- Удельная теплоемкость, Дж/г °С 2,47
- Теплота испарения, кДж/моль 64,5
- Давление насыщенного пара (при 20°С), Па 10,7
Пропиленгликоль представляет собой синтетическое органическое соединение с химической формулой C3H8O2. Это вязкая бесцветная жидкость, которая почти не имеет запаха, но обладает слегка сладковатым вкусом. Пропиленгликоль смешивается с широким спектром растворителей, включая воду, ацетон и хлороформ.
Пропиленгликоль используется в производстве полимеров, в пищевой промышленности, фармацевтике, в составах для противообледенительной обработки самолетов. Пропиленгликоль, в отличии от этиленгликоля, не токсичен.
Источник
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Параметры эксплуатации этиленгликоля
Этиленгликоль заливают в алюминиевые бочки или в бочки из коррозионно-стойкой стали. По согласованию с потребителем этиленгликоль допускается заливать в стальные неоцинкованные бочки.
Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а так же наливом в ж/д цистернах (по согласованию с потребителем — в специально выделенных ж/д цистернах).
Этиленгликоль хранят в бочках в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках их углеродистой стали.
Родственные материалы этиленгликоля
Весьма близкими к этиленгликолю по свойствам являются диэтиленгликоль, триэтиленгликоль и глицерин, которые так же являются густыми прозрачными жидкостями, легко смешивающимися с водой, спиртом, ацетоном и некоторыми другими растворителями, причем глицерин является безвредным веществом. Диэтиленгликоль широко используется как растворитель смол, масел, нитроцеллюлозы и также в качестве основы антифризов.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали.Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Физико-химические показатели Этиленгликоля (Моноэтиленгликоля, МЭГ)
| # п/п |
Наименование показателя |
Норма | |
| Высший сорт ОКП 24 2212 0120 |
1-й сорт ОКП 24 2212 0130 |
||
| 1 | Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| 2 | Массовая доля диэтиленгликоля, %, не более |
0,05 (0,10) |
1,0 |
| 3 | Цвет в единицах Хазена, не более в обычном состоянии после кипячения с соляной кислотой |
5 20 |
20 Не нормируется |
| 4 | Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| 5 | Массовая доля железа (Fе), %, не более | 0,00001 | 0,0005 |
| 6 | Массовая доля воды, %, не более | 0,1 | 0,5 |
| 7 | Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 (0,001) |
0,005 |
| 8 | Показатель преломления при 20оС | 1,431 — 1,432 | 1,430 — 1,432 |
| 9 | Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 275 350 |
75 |
Не нормируется То же То же |
Температура замерзания водного раствора зависит от массовой доли
следующим образом:
| Массовая доля этиленгликоля (%) в водном растворе | Температура замерзания, ° C |
| 10 | -4 |
| 15 | -5 |
| 20 | -9 |
| 25 | -12 |
| 30 | -14 |
| 40 | -22 |
| 50 | -35 |
| 60 | -49 |
Основы мер безопасности. Зачем избегать замерзание этого спирта?
Хранить этиленгликоль необходимо в специальной таре (такие ещё называют химическими) которую можно надёжно закрыть.
Нужно отметить, что этандиол горюч, поэтому следует избегать обращение с огнём рядом с открытым веществом, а также продумать вероятность непредвиденных ситуаций, вроде короткого замыкания.
Закрытая тара и дополнительные меры предосторожности (например, наличие хорошей вентиляции помещения при обращении с веществом) помогут избежать вдыхания большой концентрации паров этиленгликоля. Не допускайте попадания на слизистые и ни в коем случае не принимайте внутрь!
Не допускайте попадания на слизистые и ни в коем случае не принимайте внутрь!
Об этиленгликоле
В качестве присадки применяться может этиленгликоль для систем отопления.
Закипает он при температуре 197,9°C; плавится – при 12,6°C. Смешивается с водой и спиртом.
Опасен для здоровья!
Этиленгликоль является токсичным веществом. Степень вреда, который он может принести человеку, зависит от: чувствительности организма, объема вещества, состояния, в котором на момент попадания этиленгликоля внутрь, находится нервная система, наполненности желудка.
Стать причиной смерти может и не очень большое количество этиленгликоля – 50 мл. Некоторые утверждают, что отравиться можно от 50-150 мл этого вещества.
Об этом следует знать, прежде чем теплоноситель для системы отопления купить
Как видно, жидкость в систему отопления дома должна выбираться осторожно. То, каким именно образом происходит токсичное действие этиленгликоля неизвестно до сих пор
Известно, что кровь быстро впитывает этиленгликоль. Кстати, проникать в организм он может и сквозь поры. Несколько часов вещество циркулирует по кровеносной системе, не растворяясь. Пик концентрации наступает через 2-5 часов после попадания этиленгликоля в организм. Далее содержание вещества в крови уменьшается, и он начинает фиксироваться в тканях.
Действие этиленгликоля двухфазное. Если отравленный человек не погибает по истечении короткого промежутка времени, далее следует сильное поражение организма.
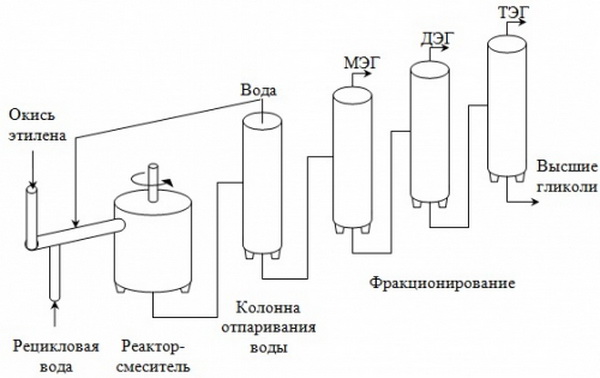
Физические свойства водного раствора этиленгликоля
В таблице представлены следующие теплофизические и физические свойства этиленгликоля в виде водного раствора различной концентрации ζ: плотность ρ, температура замерзания tз, теплоемкость C, динамическая вязкость μ, кинематическая вязкость ν, теплопроводность λ, температуропроводность a, число Прандтля Pr этиленгликоля. Физические свойства раствора этиленгликоля приведены в таблице в зависимости от температуры и его концентрации в растворе.
По данным таблицы видно, что с увеличением концентрации этиленгликоля в растворе его теплоемкость и теплопроводность уменьшаются, а температура замерзания раствора снижается при концентрации этиленгликоля до 66,3%. При дальнейшем увеличении концентрации этиленгликоля, температура замерзания раствора начинает повышаться.
В случаях применения раствора этиленгликоля в качестве антифриза в системе охлаждения автомобиля, снижение величин этих физических свойств этиленгликоля приведет к меньшему теплоотводу от двигателя. Таким образом, чем более концентрированный раствор этиленгликоля применяется в качестве охлаждающей жидкости, тем менее эффективно будет работать система охлаждения автомобиля в части отвода тепла от двигателя.
Физические свойства этиленгликоля даны в диапазоне температуры от минус 30 до 50°С и при концентрации этиленгликоля в растворе от 4,6 до 46,4 %.
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
Химическая формула гликоля — C2H6O2, рациональная — C2H4 (OH) 2, структурная — HO—CH2—CH2—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Молекула имеет подобие транс-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхлоргидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
Применение [ править | править код ]
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
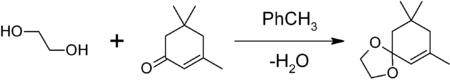
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Что представляет собой пропиленгликоль
Данное вещество имеет прямое отношение к классу двухатомных спиртов. Реактив представляет собой жидкую субстанцию с едва выраженным запахом и вкусом. В промышленности его получают в процессе гидратации окиси пропилена при давлении 16 мегапаскаль и температурном режиме в пределах 160-200 градусов.
Химическая формула пропиленгликоля – С3Н6(ОН)2. Он совершенно безопасен в применении, так не содержит токсичных элементов. Для отопительных систем используют водные растворы, в основу которых входит этот реактив.
Пропиленгликоль имеет родственный состав с этиленгликолем – С2Н4(ОН)2. Но последний элемент не используется для обогрева жилых домов, так как обладает достаточно высоким уровнем токсичности. При этом химическая формула обоих веществ имеет некую схожесть.
Как правильно использовать теплоносители на основе пропиленгликоля
Теплоносители на основе пропиленгликоля имеют схожий химический состав, который различается процентом содержания спирта. Чаще всего такие составы получают название по именованию фирмы-производителя.
Если в антифризе пропиленгликоля содержится около 30%, он замерзает при -13 °С, 35%-й раствор спирта кристаллизуется при -20 °С, 40%-й — при -25 °С, 75%-й раствор при -65°С.
При замене воды на состав на основе пропиленгликоля необходимо учесть некоторые свойства антифриза.
- Меньшая теплоёмкость и теплопроводность. Количество радиаторов стоит увеличить, а также приобрести более мощный котёл. Часто в частных домах устанавливаются отопительные системы, которые работают вполовину своей мощности — в этом случае можно обойтись без замены котла.
- Большая вязкость. Убедитесь, что трубы имеют внутренний диаметр не меньше 25 мм, а также произведите установку более крупного циркуляционного насоса.
- Больший коэффициент расширения. Если расширительный бачок меньше 10 л, то потребуется замена на более крупный.
- Высокая текучесть. Стоит уменьшить количество резьбовых соединений, врезок и сгонов, также обеспечить свободный доступ к имеющимся соединениям на случай протекания.
Если технические параметры имеющегося отопления соответствуют новым требованиям, можно переходить к подготовительным работам:
- уплотнить сгоны, соединения, врезки;
- полностью слить воду из системы отопления и промыть каустической содой, она удалит ржавчину и накипь;
- убрать все детали из цинка;
- к антифризу можно добавить присадки, которые защитят медные детали;
- грязеуловитель проверять вдвое чаще;
- через каждые два года проверять раствор на предмет концентрации спирта;
- полная смена антифриза каждые пять лет.
Всегда стоит тщательно промывать систему, если собираетесь осуществить переход на другой теплоноситель.
Применение гликолей в промышленности
Концентрированный водный раствор гликоля обладает сильной коррозионной активностью. Для защиты элементов инженерных сетей в промышленности гликоли применяются только с пакетом антикоррозионных присадок. Без этого охладительный или отопительный контур оборудования загрязняется продуктами коррозии. Образующиеся внутри пробки ведут к засорам, ухудшению эксплуатационных характеристик и поломкам оборудования.
Самая распространенная концентрация гликоля в водном растворе, при использовании в качестве теплоносителя – 40 %. Испытания показали, что водный раствор двухатомного спирта с добавлением карбоксилатных ингибиторов коррозии сохраняет свои эксплуатационные свойства до 10 лет и более лет.
Использование водных растворов диолов с пакетом противокоррозионных присадок в качестве теплоносителя исключает появление паровых пробок в отопительной системе, уменьшает кавитацию, снижает риск эрозии металла трубок и радиатора. В комплексе это значительно увеличивает эксплуатационный ресурс оборудования.
Водные растворы гликолей с различной концентрацией используются промышленности:
- Машиностроении;
- Приборостроении;
- Добывающей промышленности (нефть, газ, горнодобывающая и т.д.);
- Химической;
- Пищевой.
В качестве теплоносителя обычно применяются растворы этиленгликоля (ЭГ, МЭГ), и пропиленгликоля (ПГ).
Вам могут быть интересны следующие товары
| Наименование | Цена за кг, руб. с НДС | Покупка |
| Раствор этиленгликоля | от 37,65 руб./кг | |
| Раствор пропиленгликоля | от 37,65 руб./кг | |
| Котловая вода | от 33,25 руб./кг |
Вам могут быть интересны услуги
| Наименование | Заказ |
| Промывка инженерных и климатических систем | |
| Замена теплоносителя | |
| Промывка систем холодоснабжения | |
| Мониторинг |
Требования к антифризам
Для того чтобы хладагент работал безотказно в заданном температурном диапазоне, он должен обладать такими характеристиками:
- низкая температура замерзания;
- высокая теплопроводность;
- высокая теплоемкость;
- низкая коррозионная активность;
- стойкость к возникновению кавитации (чтобы при снижении давления в системе отопления хладагент не образовывал пузырьки, которые приводят к вибрации и гидравлическим ударам);
- низкая токсичность для людей, животных и окружающей среды;
- стабильность раствора;
- способность не образовывать отложения солей на стенках деталей системы отопления;
- доступная цена.
Как получают пропиленгликоль?
Главный промышленный способ, при котором удается получить пропиленгликоль происходит путем образования окиси пропилена. При этом различные производители могут использовать для получения этого вещества разные процессы. К примеру, это может быть некаталитический процесс высокотемпературного типа, когда при производстве описываемого вещества требуются температурные показатели от 200°C (или же от 392°F) и вплоть до 220°C (или же до 428°F).

Также это может быть каталитическая методика получения описываемого вещества, которая протекает при менее шокирующей температуре начиная от минимальных для данного процесса 150°С (или около 302°F) и до максимальных 180°C (или же до 356°F). Данный процесс идет в присутствии так называемой ионообменной смолы, а иногда в присутствии иного катализатора, такого, скажем, как небольшое количество серной кислоты, а возможно и щелочи.
Внимание, важный момент, приобретать пропиленгликоль можно только у официально зарегистрированных дистрибьюторов, поскольку на сегодняшний день, подделок этого вещества на рынке существует просто ужасающее количество