Этиленгликоль
Содержание:
- Что такое этиленгликоль
- Очистка и осушение
- Что такое этиленгликоль
- Области применения и ценовая политика продукционного ряда
- Этиленгликоль – токсичный двухатомный спирт
- Свойства
- Рейтинг теплоносителей
- Влияние вещества на организм человека
- Применение [ править | править код ]
- Концентрация этиленгликоля по массе и по объёму в водном растворе
- Температура кипения водного раствора этиленгликоля
- Температура замерзания водного раствора этиленгликоля
- Меры безопасности [ править | править код ]
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
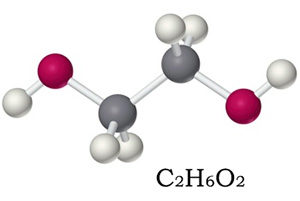
Химическая формула гликоля — C2H6O2, рациональная — C2H4 (OH) 2, структурная — HO—CH2—CH2—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Молекула имеет подобие транс-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхлоргидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Параметры эксплуатации этиленгликоля
Этиленгликоль заливают в алюминиевые бочки или в бочки из коррозионно-стойкой стали. По согласованию с потребителем этиленгликоль допускается заливать в стальные неоцинкованные бочки.
Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а так же наливом в ж/д цистернах (по согласованию с потребителем — в специально выделенных ж/д цистернах).
Этиленгликоль хранят в бочках в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках их углеродистой стали.
Родственные материалы этиленгликоля
Весьма близкими к этиленгликолю по свойствам являются диэтиленгликоль, триэтиленгликоль и глицерин, которые так же являются густыми прозрачными жидкостями, легко смешивающимися с водой, спиртом, ацетоном и некоторыми другими растворителями, причем глицерин является безвредным веществом. Диэтиленгликоль широко используется как растворитель смол, масел, нитроцеллюлозы и также в качестве основы антифризов.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали.Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Физико-химические показатели Этиленгликоля (Моноэтиленгликоля, МЭГ)
| # п/п |
Наименование показателя |
Норма | |
| Высший сорт ОКП 24 2212 0120 |
1-й сорт ОКП 24 2212 0130 |
||
| 1 | Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| 2 | Массовая доля диэтиленгликоля, %, не более |
0,05 (0,10) |
1,0 |
| 3 | Цвет в единицах Хазена, не более в обычном состоянии после кипячения с соляной кислотой |
5 20 |
20 Не нормируется |
| 4 | Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| 5 | Массовая доля железа (Fе), %, не более | 0,00001 | 0,0005 |
| 6 | Массовая доля воды, %, не более | 0,1 | 0,5 |
| 7 | Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 (0,001) |
0,005 |
| 8 | Показатель преломления при 20оС | 1,431 — 1,432 | 1,430 — 1,432 |
| 9 | Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 275 350 |
75 |
Не нормируется То же То же |
Температура замерзания водного раствора зависит от массовой доли
следующим образом:
| Массовая доля этиленгликоля (%) в водном растворе | Температура замерзания, ° C |
| 10 | -4 |
| 15 | -5 |
| 20 | -9 |
| 25 | -12 |
| 30 | -14 |
| 40 | -22 |
| 50 | -35 |
| 60 | -49 |
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колеблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.

Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией
Срок – не более пяти лет.
Этиленгликоль – токсичный двухатомный спирт
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел);
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.
Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к смерти. При однократном употреблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.

Пары данного соединения менее токсичны. Так как этиленгликоль характеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
Свойства
1,2-диоксиэтан не имеет запаха, однако, имеет сладковатый вкус. Относят к умеренно токсичным легковоспламеняющимся веществам. Легко соединяется с водой. Это используют в промышленности, так как температура замерзания таких веществ очень низкая.
Физические
Еще в прошлом веке стало известно, что этиленгликоль обладает уникальными свойствами.
Характеристики:
- температура возгорания составляет от +112 ˚С до +124 ˚С;
- самовоспламениться может при нагреве до +380 ˚С;
- чистый этиленгликоль замерзает при -12 ˚С;
- раствор на водной основе может замерзать при температуре ниже -65 ˚С, а при более низком значении начинается образование кристаллов льда;
- точка кипения чистой жидкости достигается при +121 ˚С;
- плотность — 11,114 г/см³.
Такие характеристики дают возможность применять 1,2-диоксиэтан в различных сферах производства.
Химические
Вещество имеет несколько названий, но все они означают одно и то же. Собственно, и химические свойства у них одинаковы. Если массовая доля вещества достигает 99.8%, то оно высшего сорта.
Список химических свойств:
- молярная масса — 62,068 г/моль;
- коэффициент оптического преломления — 1,4318;
- константа диссоциации кислоты — 15,1±0,1;
- умеренно токсичный.
1.2-этандиол относят к третьей группе опасности, поэтому предельно допустимые концентрации в атмосфере по ГОСТу могут быть не более 5 миллиграмм/м³.
Рейтинг теплоносителей
Что в системе отопления используете Вы?
АнтифризыВоду
Заливаемая в систему отопления жидкость должна соответствовать ряду обязательных требований. В их число входят:
- высокая степень теплоёмкости (жидкость должна максимально аккумулировать в себе и переносить с минимальными потерями тепловую энергию);
- щадящий стабильный состав (жидкость не должна вызывать коррозию внутренних поверхностей отопительного оборудования и содержать в своём составе способные образовывать накипь минеральные соли);
- широкий диапазон рабочих температур (теплоноситель должен иметь большую «вилку» между температурами закипания и замерзания).
Важными показателями для незамерзающей жидкости являются плотность, вязкость и химическая инертность. Все жидкости должны быть полностью безопасны для здоровья человека. Исходя из совокупности всех показателей можно выделить несколько групп лучших теплоносителей.
На основе пропиленгликоля
Антифризы этой группы рекомендуется использовать в отопительных системах пищевых производств, детских и медицинских учреждений. Они универсальны в применении, имеют отличные физико-химические свойства и обладают экологической безопасностью. Наиболее популярный теплоноситель этого вида – «Тёплый дом ЭКО30».
 Жидкость содержит в своём составе присадки, обеспечивающие защиту внутренних поверхностей элементов отопительной системы от коррозии и предотвращающие образование накипи. Перед заливкой в систему жидкость разбавляется дистиллированной водой.
Жидкость содержит в своём составе присадки, обеспечивающие защиту внутренних поверхностей элементов отопительной системы от коррозии и предотвращающие образование накипи. Перед заливкой в систему жидкость разбавляется дистиллированной водой.
Неправильное разведение антифриза другими жидкостями может привести к разложению в ней присадок. Основное предназначение теплоносителя – заливка в отопительные системы с оцинкованными трубами. Жидкость не образует пены.
Характеристики:
- диапазон рабочих температур – от -30 до +106°С;
- срок эксплуатации – до 5 лет;
Достоинства:
- абсолютная безопасность для людей и животных;
- взрыво- и пожаробезопасность.
Недостатки:
- нельзя использовать в системах отопления с электродными котлами;
- можно применять только для одной рабочей температуры.
На основе этиленгликоля
Антифризы этой группы имеют ограничения по применению. Используют его в системах отопления зданий, изолированных от жизнедеятельности человека. Наиболее популярный теплоноситель этого вида – «DIXIS-65». Антифриз способен снижать интенсивность  коррозии внутренних поверхностей элементов системы отопления, не образует пены.
коррозии внутренних поверхностей элементов системы отопления, не образует пены.
Он одинаково хорошо совместим с различными металлами и полимерами. Из-за низкой температуры замерзания рекомендуется к применению в районах с суровыми зимами. При заливке антифриза в отопительную систему его можно разбавить водой, но её количество не должно превышать 30% от общего объёма жидкости.
Характеристики:
- диапазон рабочих температур – от -65 до +111°С;
- срок эксплуатации – до 5 лет;
Достоинства:
- высокое качество;
- длительный срок эксплуатации.
Главный недостаток:
не рекомендуется использовать в отопительных системах, обогревающих жилые помещения.
Влияние вещества на организм человека
100 мл — смертельная доза этиленгликоля
Разумеется, наиболее тяжёлые случаи отравления происходят из-за приёма веществ, содержащих этиленгликоль, внутрь. По сути – элтиленгликоль это яд, разрушающий сосуды и клетки, вызывающий ацидоз (избыточную кислотность тканей).
В результате действие данного яда поражается центральная нервная система, выходят из строя почки.
После употребления внутрь антифриза смерть гарантированно наступает, если в жидкости содержалось 100 мл этиленгликоля. Обычно для летального исхода достаточно 50 и менее мл.
Симптомы острого отравления этиленгликолем появляются через 2-13 часов после приёма внутрь.

Отравления этиленгликолем часто происходят по вине самих пострадавших
Через 2 часа после употребления — у отравившегося могут возникнуть судороги, галлюцинации, ступор, сопор (оглушение) и кома. Может развиться отёк мозга, что почти всегда заканчивается летально.
Фотогалерея: симптомы острого отравления этиленгликолем


Далее отравление развивается следующим образом (в зависимости от дозы, состояния здоровья и особенностей обмена):
- 40% отравившихся и не погибших в первые сутки умирают в течении месяца от почечной недостаточности;
- Остальные выживают, отделавшись лишь преходящими поражениями нервной системы и последующими хроническими заболеваниями почек (гломерулонефриты, пиелонефриты,).

Почти половина тех, кто отравился этиленгликолем и не погиб в первые сутки, могут умереть от почечной недостаточности
В почках активно откладываются кристаллы оксалата, что в последствии может трансформироваться в мочекаменную болезнь у выживших.
Кроме этого, в течение первых 3х суток может развиваться отёк лёгких, пневмония и молниеносная форма сердечной недостаточности из-за сосудистого компонента отравления.
Сердечная недостаточность, кстати, может остаться и после излечения таких больных. В таких случаях, как правило, приводит к гибели пациентов в течении 5 следующих лет.
Отравление парами этиленгликоля на химическом производстве
Ядовит как сам этиленгликоль, так и его эфиры, проникающие в организм через кожу.
Последнее наблюдается в условиях химического производства.
У рабочих, вследствие хронического отравления парами этиленгликоля, возникают явления вегетативно-сосудистой дистонии.
Постепенно снижается жизненный тонус, появляется мышечная слабость и сонливость, вплоть до потери сознания.
Фотогалерея: симптомы хронического отравления парами этиленгликоля




Уменьшается активность и количество клеток белой крови (лейкоциты, лимфоциты, нейтрофилы). Клеточные элементы деформируются, эритроциты хуже справляются с переносом кислорода, их форма изменяется.
Начинаются проблемы с глазами – постоянные конъюнктивиты, сухость. Из-за поражения нервной системы появляется нистагм.
Активизируются фарингиты, ларингиты, бронхиты. Многие рабочие жалуются на постоянную тошноту, боли в животе, рвоту. Может развиваться олигурия и анурия (исчезает мочеиспускание, вплоть до развития гидронефроза почки).
Применение [ править | править код ]
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
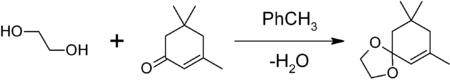
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Концентрация этиленгликоля по массе и по объёму в водном растворе
В таблице приведены соотношения концентрации в водном растворе по массе и по объёму.
| Содержание этиленгликоля по массе (в процентах) | ||||||||
| 5% | 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| Концентрация этиленгликоля по объёму (в процентах) | 4,51% | 9,06% | 18,31% | 27,76% | 37,41% | 47,27% | 57,31% | 67,66% |
Температура кипения водного раствора этиленгликоля
Приведена диаграмма по температурам кипения водного раствора этиленгликоля в зависимости от его содержания по массе в процентах при давлении атмосферного воздуха 760 мм.рт.ст. С увеличением концентрации этиленгликоля с 10% до 50% по массе температура кипения раствора повышается всего лишь с 101,1 до 107,2 градуса Цельсия.
Вода (без содержания этиленгликоля)100 oC
100oC
Вода (90%) + Этиленгликоль (10%)101.1 oC
101.1oC
Вода (70%) + Этиленгликоль (30%)104,4 oC
104,4oC
Вода (50%) + Этиленгликоль (50%)107,2 oC
107,2oC
Этиленгликоль (60%) + Вода (20%)110,0 oC
110,0oC
Этиленгликоль (90%) + Вода (10%)140,6 oC
140,6oC
Этиленгликоль (95%) + Вода (5%)158,3 oC
158,3oC
Температура замерзания водного раствора этиленгликоля
Приведена диаграмма по температурам замерзания водного раствора этиленгликоля в зависимости от его содержания по массе в процентах.
Примечательно, что при концентрации этиленгликоля от 10% до 20% температура замерзания водного раствора понижается незначительно от -3,2 до -7,8 градуса Цельсия.
С последующим доведением концентрации этиленгликоля до 50% температура замерзания раствора достаточно резко снижается до -33,8 градусов Цельсия.
Это свойство этиленгликоля позволяет использовать его в технологических процессах в качестве теплоносителя с низкими значениями рабочих температур.
Сравнительная температура замерзания раствора этиленгликоля с водой
Вода (без добавки этиленгликоля)-1,0 oC
-1,0oC
Вода (90%) + Этиленгликоль (10%)-3,2oC
-3,2oC
Вода (90%) + Этиленгликоль (20%)-7,8oC
-7,8oC
Вода (70%) + Этиленгликоль (30%)-14,1oC
-14,1oC
Вода (50%) + Этиленгликоль (50%)-33,8oC
-33,8oC
Этиленгликоль (60%) + Вода (40%)-48,5oC
-48,5oC
Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

Получение многоатомных спиртов
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:


II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):
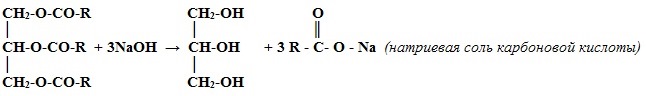
Химические свойства многоатомных спиртов
1. С активными металлами:
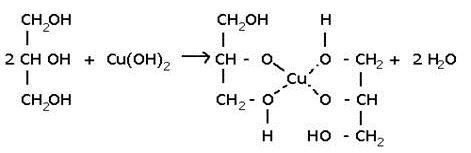
2. С гидроксидом меди( II ) – качественная реакция!

1. С галогенводородными кислотами

Т ринитроглицерин — основа динамита
- Этиленгликольпроизводства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканейи в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.